Bientôt, plus de cholestérol et même… de VIH ? Après une seule perfusion ? Avec CRISPR, la médecine ne sera plus jamais comme avant.
À l’origine, CRISPR est un mécanisme que les bactéries utilisent pour se défendre contre les virus, en coupant leur ADN. Des chercheurs, dont Emmanuelle Charpentier et Jennifer Doudna, récompensées par le prix Nobel de chimie en 2020, ont adapté ce système pour modifier notre propre ADN avec une précision incroyable. En seulement dix ans, cette technologie est passée des laboratoires aux hôpitaux, en offrant une formidable perspective : celle qui permet de traiter des maladies graves de manière définitive avec… parfois une seule injection. Et ce, en corrigeant directement leur cause dans nos gènes. C’est un espoir immense pour des maladies jusqu’ici jugées incurables. Ce mécanisme fonctionne comme des ciseaux moléculaires guidés par une carte ultra-précise. Ils peuvent couper, remplacer ou ajuster une partie de l’ADN pour réparer un gène défectueux ou en désactiver un qui pose problème.
Cette technologie suit deux grandes approches. La première, dite édition « ex vivo », où l’on prélève des cellules du patient avant de les modifier en laboratoire et de les réinjecter. La seconde est « in vivo » : tout le processus se déroule directement dans le corps, souvent grâce à de minuscules transporteurs appelés nanoparticules lipidiques. Ils livrent l’outil CRISPR là où il faut, comme dans le foie ou d’autres organes. Des versions plus avancées, comme le « base editing » ou le « prime editing », permettent même de faire des modifications ultra-fines sans abîmer l’ADN, réduisant ainsi les risques d’erreurs.
Pour mesurer véritablement la portée de cette révolution, rien de plus éloquent que de jeter un œil sur différents essais cliniques ayant éprouvé le principe.
La foire aux essais cliniques !
Il y a encore quelques années, les premiers essais avec CRISPR faisaient la une des journaux comme des exploits rares. Aujourd’hui, le paysage a changé. Environ 250 essais cliniques sur l’édition génétique ont vu le jour, dont 150 sont en cours. Et près de la moitié utilisent CRISPR ! Depuis le tout premier, en 2016, seulement quatre ans après la découverte majeure de Charpentier et Doudna, la technologie a fait un bond incroyable. Ces essais ciblent des maladies variées : cancers, troubles du sang, pathologies cardiovasculaires, infections comme le VIH et maladies rares. L’objectif commun ? Un traitement en une seule fois qui corrige la cause profonde d’un problème, plutôt que de soigner ses symptômes à répétition.
Mais des questions subsistent. Le mécanisme est-il réellement efficace ? Quelle est la durée de ses effets ? Est-ce sans danger ? Et surtout, pourra-t-on rendre ces traitements accessibles à tous ? Des interrogations qui se dissipent au fur et à mesure que les essais cliniques livrent leurs vérités.
En Verve pour réduire le cholestérol
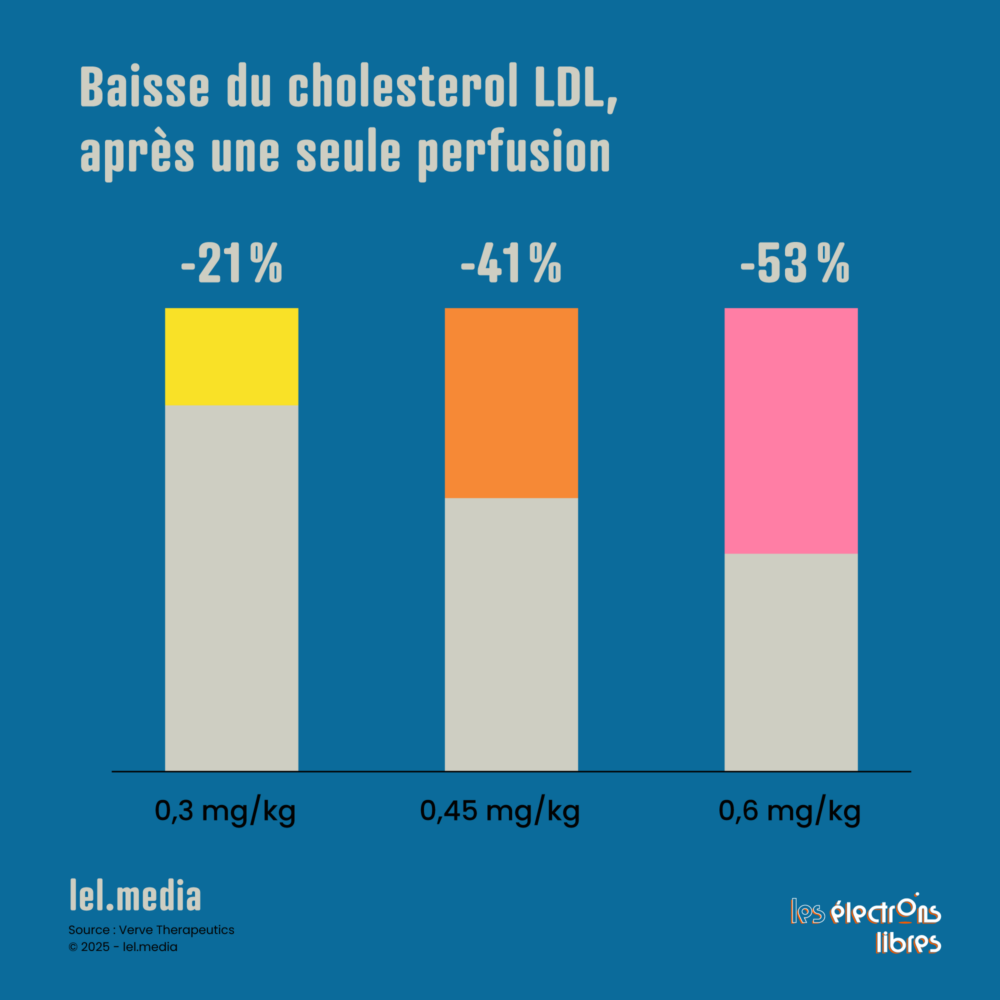
L’essai VERVE-102, mené par Verve Therapeutics, veut révolutionner la lutte contre le « mauvais » cholestérol (LDL), qui bouche les artères et cause des crises cardiaques. En une seule injection, CRISPR désactive un gène appelé PCSK9 dans le foie, ce qui réduit fortement le problème. Les premiers résultats de 2025 montrent une baisse moyenne de 53 % du LDL, et jusqu’à 69 % pour certains patients, sans effets secondaires graves. Si la durabilité des résultats est au rendez-vous, comme l’espèrent les chercheurs, cela pourrait remplacer les médicaments quotidiens pour les personnes à risque, telles celles ayant un cholestérol élevé héréditaire. Prochaines étapes : confirmer que cela reste sûr et efficace sur le long terme, pour en faire un traitement courant.
VIH caché… dévoilé
Le VIH est un virus malin. Même avec des traitements, il se dissimule dans l’ADN de certaines cellules et peut revenir si l’on arrête les médicaments. L’essai EBT-101 d’Excision BioTherapeutics utilise CRISPR pour couper et éliminer ces morceaux de virus cachés. Les premières données montrent une bonne tolérance au traitement, sans rebond important du virus. Mais le vrai défi est de prouver que les patients peuvent arrêter leurs médicaments sans que le VIH revienne. Si cet essai réussit, ce serait une avancée majeure contre une maladie qui touche des millions de personnes. Les chercheurs planchent déjà sur des moyens de rendre le traitement plus puissant et plus facile à produire à grande échelle.
Sus à la drépanocytose
La drépanocytose est une maladie génétique qui déforme les globules rouges, provoquant des douleurs intenses et des complications graves. Avec BEAM-101, Beam Therapeutics propose une solution : prélever les cellules souches du patient, puis utiliser CRISPR pour réactiver un gène qui produit une hémoglobine saine (comme celle des bébés), avant de réinjecter ces cellules. Les résultats de 2025 sur 17 patients montrent une forte hausse de cette hémoglobine (plus de 60 %), moins de complications et une meilleure qualité de vie, sans crises douloureuses. Mais le traitement est complexe et coûteux, nécessitant des hôpitaux spécialisés. L’objectif à long terme est de simplifier le processus pour le rendre accessible à plus de patients, notamment dans les régions où la maladie est courante.
Dire stop à l’amylose
L’amylose à transthyrétine (ATTR) est une maladie où une protéine toxique s’accumule dans le cœur, les yeux, le système nerveux ou les reins, causant de graves problèmes, notamment cardiaques. L’essai NTLA-2001 d’Intellia Therapeutics utilise CRISPR pour désactiver le gène responsable de cette protéine, avec une seule perfusion. Les résultats montrent une chute durable de l’intrus toxique, et l’essai de phase 3, en cours en 2025, vérifie si cela améliore la vie des patients. Moins d’hospitalisations, une meilleure santé cardiaque, une vie plus longue ? Si les réponses sont positives, ce traitement pourrait devenir une référence pour cette maladie grave.
Une statue pour Emmanuelle Charpentier et Jennifer Doudna ?
CRISPR ouvre une nouvelle ère pour la médecine, avec des traitements qui semblaient autrefois de la science-fiction. Des maladies du cœur au VIH, en passant par des troubles génétiques rares, cette technologie promet des solutions durables, souvent en une seule intervention. Si les défis de sécurité, d’efficacité et d’accessibilité sont relevés, elle pourrait changer des millions de vies. L’avenir s’écrit aujourd’hui, et CRISPR en est l’une des plumes les plus prometteuses. De quoi bientôt ériger une statue à la gloire d’Emmanuelle Charpentier et Jennifer Doudna ?